Bài tập hóa lớp 9
Bạn đang xem: Bài tập hóa lớp 9
1. Tính năng với phi kim
a) chức năng với oxi: phần đông kim loại (trừ Au, Pt, Ag,…) công dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, chế tạo ra thành oxit.
b) công dụng với phi kim khác (Cl.,, S,…): các kim loại chức năng với nhiều phi kim, chế tạo ra thành muối.
2. Tác dụng với hỗn hợp axit
Nhiều kim loại tính năng với hỗn hợp axit (HCl,…) chế tạo thành muối và H2.
3. Tác dụng với dung dịch muối
Kim lọại hoạt dộng mạnh khỏe hơn (trừ Na, K, Ba,…) tính năng với muối của kim loại yếu hơn, chế tạo ra thành muối bột và sắt kẽm kim loại mới.
Giải bài xích SGK bài bác 16 Hóa Lớp 9 trang 51
Bài 1: Kim loại có những đặc thù hoá học tập nào ? lấy thí dụ và viết các phương trinh hoá học tập minh hoạ với sắt kẽm kim loại magie.
Các em tìm hiểu thêm phần lý thuyết ở mục A phía trên.
Xem thêm: Nồi Chiên Không Dầu Philip 9643 Giá Tốt, Nồi Chiên Không Dầu Philips Hd9643
Bài 2 Hãy viết các phương trình hoá học tập theo các sơ vật dụng phản ứng tiếp sau đây :
a) …… + HCl —> MgCl2 + H2;
b) …… + AgNO3 —> Cu(NO3)2 + Ag;
c) …… + ……. —> ZnO;
d) ….. + Cl2 —> CuCl2
e) ….. + S —> K2 S.
Giải bài bác 2: Hãy viết các phương trình hoá học tập theo các sơ vật phản ứng tiếp sau đây :
a) Mg + 2HCl —> MgCl2 + H2↑;
b) Cu + 2AgNO3 —> Cu(NO3)2 + 2Ag↓;
c) 2Zn + O2 —>t0 2ZnO;
d) Cu + Cl2 —>t0 CuCl2
Quảng cáo
e) 2K + S —> K2 S t0
Bài 3. (Trang 51): Viết những phương trình hoá học của các phản ứng xảy ra giữa các cặp chất sau đây:
a) Kẽm + Axit sunturic loãng ; b) Kẽm + Dung dịch bạc bẽo nitrat;
c) Natri + lưu hoàng ; d) can xi + Clo.
Giải bài xích 3:
a) Zn + H2SO4 -> ZnSO4 + H2 ↑
b) Zn + 2AgNO3 -> Zn(NO3)2 + 2Ag ↓
c) 2Na + S -> Na2S
d) Ca + Cl2 -> CaCl2
Bài 4: Dựa vào đặc điểm hoá học của kim loại, hãy viết những phương trình hoá học trình diễn các thay đổi sau trên đây :
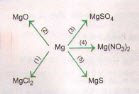
Giải bài xích 4:
Quảng cáo
Có thể có các PTHH sau:
1) Mg + Cl2 —>t0 MgCl2
2) 2Mg + O2 —>t0 2MgO
3) Mg + H2SO4 —> MgSO4 + H2 ↑
4) Mg + Cu(NO3)2 —> Mg(NO3)2 + Cu ↓
5) Mg + S —>t0 MgS
Bài 5: Dự đoán hiện tượng kỳ lạ và viết phương trình hoá học tập khi:
a) Đốt dây sắt trong khí clo.
b) cho một đinh fe vào ống thử đựng hỗn hợp CuCl2.
c) cho một viên kẽm vào dung dịch CuS04.
Giải: a) sương màu nâu đỏ sinh sản thành: 2Fe + 3Cl2 —>t0 2FeCl3
b) hỗn hợp CuCl2 —> FeCl2 + Cu ↓
c) dung dịch CuSO4 nhạt màu, kim loại màu đỏ bám ngoài viên kẽm: Zn + CuSO4 —> ZnSO4 + Cu ↓
Bài 6 trang 51 hóa 9: Ngâm một lá kẽm trong đôi mươi g hỗn hợp muối đồng sunfat 10% cho tới khi kẽm không tan được nữa. Tính trọng lượng kẽm đang phản ứng với hỗn hợp trên với nồng độ tỷ lệ của hỗn hợp sau phản nghịch ứng.
Giải bài xích 6:
Ta có: mCuSO4 = 20.0,1 = 2(g)
=> nCuSO4 = 0,0125 (mol)
PTHH: Zn + CuSO4 —> ZnSO4 + Cu ↓
1 mol 1 mol 1 mol
0,0125 mol 0,0125 mol 0,0125 mol
=> mZn = n.M = 0,0125. 65 = 0,81 (g)
mZnSO4 = n.M = 0,0125. 161= 2,01 (g)
m dd sau pư = mddCuSO4 + mZn – m Cu giải phóng
Nồng độ % hỗn hợp ZnSO4 là: C% = (2,01/20).100% = 10,05 (%)
Bài 7: Ngâm một lá đồng trong trăng tròn ml dung dịch bạc đãi nitrat cho tới khi đồng thiết yếu tan thêm được nữa. Rước lá đồng ra, cọ nhẹ, làm khô và cân nặng thì thấy khối lượng lá đồng tăng lên 1,52 g. Hãy khẳng định nổng độ mol của dung dịch bạc bẽo nitrat đã sử dụng (giả thiết toàn thể lượng bạc bẽo giải phóng dính hết vào lá đồng).











